Архивы рубрики ‘СТРОИТЕЛЬНЫЕ. МАТЕРИАЛЫ И ИЗДЕЛИЯ’
ОСНОВНЫЕ СВОЙСТВА СТРОИТЕЛЬНЫХ. МАТЕРИАЛОВ
В соответствии с агрегатным состоянием дисперсионной среды (см. подразд. 1.1) свойства материалов можно подразделить на три группы.
1. Технические свойства материала как готового продукта, которые можно, в свою очередь, подразделить на общие свойства, характерные для всех материалов, и специальные. К общим относятся физико-механические свойства, долговечность; к специальным свойствам относятся теплопроводность, паро — и водонепроницаемость, стойкость к истиранию, звукопоглощение и другие свойства, определяющие назначение материала.
2. Технологические свойства, характеризующие способность исходных материалов при получении изделий перемешиваться, экструдироваться, формоваться, уплотняться. К технологическим свойствам относятся пластичность, вязкость, предел текучести, удобоукладываемость, способность к той или иной обработке, скорость твердения и т. д.
3. Свойства сырьевых компонентов, предопределяющие качество конечного продукта. Например, для бетона важны свойства цемента, заполнителей и добавок. Качество керамического черепка зависит от свойств глины, а пластмасс — от свойств полимеров и наполнителей.
Экспериментально получаемые характеристики материалов зависят от методики их определения. Поэтому технические требования к материалам формулируют исходя из стандартных методов испытаний.
Поверхностные явления и формирование свойств материалов
Явления смачивания. Если молекулы жидкости взаимодействуют с молекулами твердого тела сильнее, чем между собой, то капля жидкости растекается по поверхности — смачивает ее. При этом краевой угол смачивания 0 < 90°, a cos 0 > 0 (рис. 1.2, а).
Если между собой молекулы жидкости взаимодействуют сильнее, чем с молекулами твердого тела, то капля жидкости не растекается: 0 > 90°, cos 0 < 0. Крайними случаями этого процесса являются полное смачивание, когда 0 = 0, cos 0 = 1 (жидкость растекается до образования мономолекулярного слоя) и полное несмачивание, когда 0 = 180°, cos 0 =-1 (капля стремится сохранить сферическую форму).
Способность поверхностей тел смачиваться водой является результатом действия трех сил поверхностного натяжения о на границах твердое тело —газ (т — г); твердое тело—жидкость (т—ж);
а
жидкость —газ (ж—г) (рис. 1.2, б). Растекание капли прекратится, когда наступит равновесие этих сил, действующих на каждой единице длины периметра смачивания. Условие равновесия выражается уравнением Юнга:
ат_г = ат_ж + ox_rcos 0 или cos 0 = (ат_г-ах_ж)/стж_г. (1.1)
По способности смачиваться водой поверхности тел подразделяются на гидрофильные (смачиваемые) с cos 0 > 0 и гидрофобные (несмачиваемые) с cos 0 < 0.
Краевой угол смачивания составляет: для кварца — 0°, малахита — 17°, графита — 55°, талька — 69°, парафина — 106°, тефлона —
 |
Реальная поверхность никогда не бывает совершенно чистой. Присутствие на поверхности загрязняющих веществ, оксидных пленок, адсорбированного воздуха оказывает сильное влияние на смачиваемость. Гидрофильная поверхность кварца, покрытая тонкой пленкой масла или жира, становится гидрофобной.
Адгезия и когезия. В гетерогенных системах различают межмолекулярные взаимодействия (притяжение молекул) между разными фазами (адгезия) и внутри одной фазы {когезия).
Силы адгезии действуют на очень малых расстояниях. Для их возникновения необходим контакт фаз. В случае твердых тел обеспечить значительную площадь контакта чрезвычайно трудно даже при высоком давлении. Если сложить пластины с плоскими шлифованными поверхностями, то можно почувствовать их слипание. Значительные силы адгезии возникают, если смочить поверхности пластин водой или другой жидкостью, так как жидкость вступает в контакт с твердым телом по всей площади смоченной поверхности. Таким образом, чтобы обеспечить хорошее прилипание, необходимо одну из фаз перевести в жидкое или вязкопластичное состояние. Этот принцип используется при склеивании, пайке, сварке материалов, нанесении на поверхность лакокрасочных, гидроизоляционных покрытий, штукатурных растворов, получении композиционных материалов (пластмасс, бетона, керамических изделий), когда наполнители или заполнители сме
шивают с жидким связующим, которое впоследствии переводят в твердое состояние.
Когезионное взаимодействие характеризуют работой когезии 1VK, Дж/м2, необходимой для разрыва фазы, по сечению единичной площади. При разрыве фазы образуются две поверхности (площадь каждой равна единице) с поверхностным натяжением в случае жидкости <тж_г, а в случае твердого тела ох__г (рис. 1.3, а). Следовательно, работа когезии жидкости равна WK = 2ож_г, а твердого тела — = 2от_г.
Работа адгезии определяется энергией, затраченной на разрыв связи по контакту между фазами, отнесенной к единице площади. Определим работу адгезии Wa, Дж/м2, между жидкостью и твердым телом в газообразной среде. До разрыва поверхностная энергия единицы площади контакта равна от_ж. После разрыва образуются две поверхности с поверхностным натяжением, равным на одной из них аж_г, на другой — от_, (рис. 1.3, б). В этом случае работа адгезии определяется по уравнению Дюпре:
В/, — ож_г + от_г— от_ж. (1.2)
Выразим от_г из уравнения (1.1) и подставим в уравнение (1.2). Получим: fVa = стж_г(1 + cos0). Величины аж_г и cos в определяются экспериментально.
Отношение работ адгезии и когезии для случая твердое тело — жидкость зависит только от краевого угла смачивания:
К/ И4 = стж-і( 1 + СО50)/2ОЖ„Г = (1 + cos0)/2.
При cos0 = 1 (полное смачивание) Wa = WK, т. е. разрыв при растяжении равновероятен как по контакту, так и по жидкости. При cos0 =-1 (полное несмачивание) Wa = 0, следовательно, нет адгезии. В промежуточном случае, при cos0 = 0, Wa = 0,5 WK.
|
Жидкость |
Жидкость |
|||||
|
Жидкость |
/ |
Жидкость |
/ |
|||
|
а = 0 |
сг Газ -Г |
ж — Г |
<*т-ж |
ч стж Газ -г |
||
|
£=1 |
5=1 |
G’p |
||||
|
—— |
Жидкость |
Твердое тело |
Твердое тело |
|
а |
|
б |
|
Рис. 1.3. Иллюстрация к выводу уравнения Дюпре: а — когезия; б — адгезия; S — площадь столбика |
|
о л -s;
Рис. 1.4. Происхождение внутреннего давления в жидкости (а), поднятие (опускание) жидкости в капилляре (б) и удержание твердых частиц водной манжетой (в) |
Работу адгезии между твердыми фазами определить невозможно, так как обычно неизвестно поверхностное натяжение на границе твердое тело — воздух. В этом случае адгезию характеризуют силой, необходимой для разрыва адгезионного соединения по единице площади.
Капиллярные явления. Благодаря поверхностному натяжению жидкости стремятся принять сферическую форму. Этому препятствует сила тяжести, которая при большом объеме жидкости делает поверхность плоской. С уменьшением объема жидкости Ксила тяжести снижается пропорционально кубу радиуса капли, в то время как поверхность капли уменьшается пропорционально квадрату радиуса.
При малых размерах частиц силы поверхностного натяжения начинают преобладать над силами тяжести и поверхность приобретает кривизну, благодаря которой капля оказывается сжатой внутренним давлением р, обусловленным силами поверхностного натяжения о и направленным к центру кривизны (рис. 1.4, а). Под действием этого давления объем капли уменьшается на 8Ки совершается работа рЪ V В то же время сокращается площадь поверхности капли на 5.S’ и уменьшается ее поверхностная энергия на o8S.
При равновесии, если считать температуру тела неизменной, согласно закону сохранения энергии можно записать (уравнение Лапласа):
рЪУ — a&S, или р = об^/бК. (1.3)
Для сферы
где г — радиус сферы.
Тогда р = 2а/г, где 1 /г — это дисперсность. Чем больше дисперсность, тем выше внутреннее давление в капле.
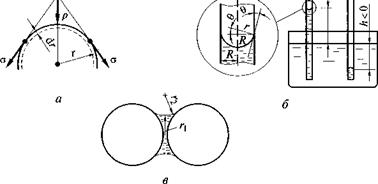
Искривление поверхности жидкости (образование мениска) имеет место в узких капиллярах. В зависимости от направления кривизны мениска (направления внутреннего давления р) происходит поднятие или опускание жидкости в капилляре (рис. 1.4, б). Это определяется смачиваемостью стенок капилляра. В гидрофильном капилляре (0 < 90°) мениск вогнутый, происходит поднятие жидкости; в гидрофобном капилляре (0 > 90°) мениск выпуклый, жидкость выталкивается из капилляра.
Рассчитаем высоту h поднятия жидкости в гидрофильном капилляре радиусом R. В состоянии равновесия капиллярное давление р, определяемое по формуле (1.3), уравновешено весом столбика жидкости, равным рgh, т. е. рgh = 055/8К Полагая, что мениск имеет сферическую форму (65/5V = 2/г), и учитывая соотношение между радиусом мениска г и радиусом капилляра R (г = R/cos0), получаем
где о — поверхностное натяжение воды; 0 — краевой угол смачивания; р — плотность воды; g — ускорение свободного падения.
Из формулы (1.4) следует, что для одной и той же жидкости (о = const, р = const) высота капиллярного поднятия тем больше, чем меньше радиус капилляра и выше его гидрофильность (cos0). При cos 0 < 0 (гидрофобный капилляр), h < 0 жидкость не втягивается в капилляр. Для того чтобы вдавить жидкость в гидрофобный капилляр до уровня h = 0, нужно приложить давление р =-2ocos0/7?. На этом принципе основан способ гидроизоляционной защиты конструкций. Материалы обрабатывают специальными проникающими составами, которые покрывают стенки капилляров тончайшей гидрофобной пленкой (см. подразд. 14.12). При этом жидкая влага не может проникнуть в поры материала, а пары воды могут свободно выходить из пор.
Бетонная смесь и керамическая масса обладают связностью в основном за счет сил поверхностного натяжения воды, действующих в водных манжетах, имеющих два радиуса кривизны (рис. 1.4, в). Радиус ги лежащий в плоскости, перпендикулярной рисунку, всегда больше радиуса г2, лежащего в плоскости рисунка, поэтому давление в водной манжете ниже внешнего, что и способствует удержанию частиц вместе.
Адсорбция. Поверхность раздела фаз, обладая свободной энергией, притягивает к себе атомы (ионы) или молекулы веществ,
находящихся в газовой фазе или жидком растворе, что ведет к понижению поверхностной энергии. Это явление называется адсорбцией, а обратный процесс называется десорбцией. В результате адсорбции концентрация вещества в объеме раствора снижается, а в поверхностном слое возрастает до тех пор, пока не установится равновесие. Если в растворе находится несколько веществ, то предпочтительнее адсорбируется то, которое сильнее уменьшает поверхностное натяжение. Твердая фаза является адсорбентом (веществом, на поверхности которого происходит адсорбция) по отношению к жидкости или газу. На поверхности раздела жидкость-жидкость или жидкость —газ могут адсорбироваться молекулы как из одной, так и из другой фазы. В этом случае адсорбат (адсорбированное вещество) представляет собой разделительный слой между ними.
Адсорбция бывает физической — обратимой и химической (или хемосорбцией) — необратимой. При физической адсорбции между адсорбентом и адсорбатом действуют силы межмолекулярного притяжения, а при химической адсорбции — силы химической связи (силы, которые действуют между атомами в молекулах). При хемосорбции происходит химическая реакция между адсорбентом и адсорбатом с образованием поверхностной молекулы, одна часть которой принадлежит адсорбенту, а другая — адсорбату.
Адсорбцию характеризуют величиной
А = Ms/S,
где Ms — масса адсорбата в поверхностном слое; S — площадь межфазной поверхности.
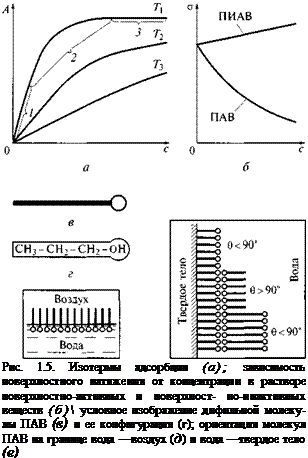
Изотермы адсорбции из раствора (графики зависимости адсорбции А от концентрации растворенного вещества с при постоянной температуре Т) приведены нарис. 1.5, а(Т3> Т2> Г,). Крутой подъем изотермы (участок 1) характерен для относительно свободной поверхности адсорбента. Полному насыщению поверхности адсорбатом соответствует участок 3. Участок 2 является промежуточным. С повышением температуры усиливается тепловое движение молекул и адсорбция уменьшается, однако предел, к которому она стремится, остается тем же, только для его достижения требуется высокая концентрация, часто нереализуемая.
При адсорбции выделяется теплота, так как снижается поверхностная энергия адсорбента.
Если с увеличением концентрации вещества поверхностное натяжение на границе раздела фаз понижается, то такое вещество называется поверхностно-активным (ПАВ). Вещества, повышающие поверхностное натяжение раствора с увеличением концентрации, называются поверхностно-инактивными (ПИАВ) (рис. 1.5, б). Такими веществами по отношению к воде являются неоргани-
д е
ческие соли, которые взаимодействуют с водой сильнее, чем молекулы воды между собой.
Молекулы ПАВ дифильны, т. е. имеют гидрофобную (выталкиваемую из воды) углеводородную часть (цепочку из групп СН2) и гидрофильную (втягиваемую в воду) функциональную группу: —СООН, —NH2, —ОН, —О — , —S020H и др. В условном изображении дифильной молекулы функциональную группу обозначают кружочком, а гидрофобный углеводородный радикал — чертой (рис. 1.5, в, г). В адсорбционном слое дифильные молекулы обращены полярной группой к полярной фазе (например, к воде), а неполярным углеводородным радикалом — к неполярной фазе (например, к воздуху) (рис. 1.5, д). На твердой поверхности ПАВ способны образовывать полимолекулярные слои (рис. 1.5, ё), при
чем от числа мономолекулярних слоев зависит, будет ли поверхность гидрофильной (0 < 90°) или гидрофобной (0 > 90°).
Широко применяются ПАВ в технологии строительных материалов в качестве добавок пластификаторов бетонной смеси, полимерных композиций, керамической массы; эмульгаторов и стабилизаторов в лакокрасочных материалах; пенообразователей при получении пенобетона и пеносиликата и др.
Структура и ее влияние на свойства материалов
В зависимости от скорости охлаждения расплава можно получить вещество в кристаллическом или аморфном состоянии. Эти два состояния вещества отличаются атомной структурой и свойствами.
Кристаллическая структура. Кристаллическая структура образуется при очень медленном охлаждении расплава, когда атомы (ионы) имеют возможность перемещаться в пространстве и занимать наиболее устойчивые положения, в которых их потенциальная энергия в силовом ноле окружающих атомов минимальна. Для удаления атома из вещества нужно сообщить ему энергию, достаточную для преодоления удерживающих сил. Эта энергия характеризует силу связи атома в кристалле.
Располагаясь наиболее устойчиво, каждый атом оказывается окруженным соседями одинаковым образом. Линии, проведенные через центры атомов в трех направлениях, являются прямыми и образуют так называемую кристаллическую решетку, элементарная ячейка которой имеет форму, характерную для данного вещества. Далее мы рассмотрим кубическую решетку, которая бывает усложнена наличием атомов в центре объема каждой ячейки (объемно-центрированная решетка) или в центре каждой грани (гранецентрированная решетка).
Анизотропия кристалла — неравномерность свойств в разных направлениях — является следствием периодичности расположения атомов в кристалле. От направления зависят не все свойства, а только те, которые характеризуются векторными величинами (прочность, упругость, теплопроводность, удлинение). Свойства, характеризуемые скалярными величинами, от направления не зависят (плотность, теплоемкость, влажность и др.).
Анизотропия материалов обусловлена также их макростроением, например расположением волокон древесины вдоль оси ствола.
Материалы, состоящие из большого числа случайно ориентированных анизотропных кристаллических зерен, изотропны.
Полиморфизм (аллотропия) — способность некоторых веществ под действием температуры и давления изменять структуру кристаллической решетки, образуя несколько аллотропических модификаций одного и того же вещества. Хорошо известны две модификации углерода: графит (один из самых мягких минералов) и алмаз (самый твердый минерал). Кварц (Si02) при нагревании до 573 °С переходит из р — в а-модификацию; затем при температуре 870 °С он переходит в тридимит, который при температуре 1 470 °С переходит в кристобалит. Явление полиморфизма часто наблюдается у металлов.
Изоморфизм — способность близких по составу веществ встраиваться в кристаллическую решетку друг друга без изменения ее структуры, т. е. образовывать твердые растворы замещения (изоморфные смеси).
В реальных кристаллах далеко не все атомы располагаются правильным образом. В отдельных узлах кристаллической решетки атомы могут отсутствовать, образуя вакансии; некоторые атомы могут находиться в междоузлии. В решетку могут быть внедрены чужие атомы — примеси.
Если одна из атомных плоскостей (совокупность атомов, находящихся в одной плоскости), начинаясь на одном конце кристалла, обрывается внутри его и не доходит до другого конца, то такой дефект называется краевой дислокацией.
Существует также винтовая дислокация — смещение атомов, при котором атомные плоскости образуют одну винтовую поверхность. Дефектом является также граница между зернами в кристаллических материалах — зона перехода между кристаллами, повернутыми относительно друг друга на некоторый угол. Она представляет собой поверхность выхода дислокаций.
Вследствие наличия дефектов прочность реальных кристаллов на несколько порядков ниже, чем идеальных.
Аморфная структура. Аморфная структура образуется при быстром охлаждении расплава, когда атомы при переходе в твердое состояние не успевают образовать кристаллическую решетку, а остаются вблизи тех положений, которые занимали в жидкости. Аморфная структура не является совершенно беспорядочной. Некое подобие порядка наблюдается в ближайшем окружении атомов. Аморфное состояние вещества является термодинамически неустойчивым (метастабильным) в отличие от кристаллического состояния. Поэтому при нагреве, когда атомы приобретают определенную подвижность, в аморфном теле происходит кристаллизация. Термодинамическая неустойчивость обусловливает и более высокую химическую активность аморфных веществ.
Аморфные вещества прозрачны, так как не имеют границ между кристаллами, рассеивающих световые волны. Такие вещества называются стеклами, а их структура — стеклообразной. В строительстве применяются стекла, получаемые из минеральных и полимерных расплавов.
Структуры многофазных систем очень разнообразны. В самом общем случае они различаются по виду контактов между частицами.
Материалы с жидкой дисперсионной средой (на стадии формования) имеют коагуляционную структуру со сравнительно слабыми контактами, осуществляемыми через жидкую прослойку и допускающими сдвиг частиц относительно друг друга. Расстояние между частицами (толщина прослойки) зависит от концентрации дискретной фазы и составляет от 1 до 100 нм. К малоконцентрированным системам относятся многие лакокрасочные материалы, представляющие собой суспензии тонкодисперсных пигментов и наполнителей в связующей жидкости. Высококонцентрированными дисперсными системами являются бетонные и растворные смеси, керамическая масса, мастики и др.
Для материалов с твердой дисперсионной средой характерны прочные контакты между «сросшимися» частицами. Структуру аморфных тел в этом случае называют конденсационной, а структуру кристаллических фаз — кристаллизационной.
ФОРМИРОВАНИЕ СТРУКТУРЫ и свойств. СТРОИТЕЛЬНЫХ МАТЕРИАЛОВ
1.1. Понятие о материалах как многофазных системах
Многофазность, т. е. неоднородность (гетерогенность), материалов обусловлена присутствием в их структуре частей (зерен, кристаллов, прослоек, пор и т. д.) различного химического состава, физических свойств и агрегатного состояния. Например, в структуре полиминеральных горных пород присутствуют кристаллы, различающиеся по цвету, форме и химическому составу. То же самое можно видеть под микроскопом в структуре стали и многих других материалов. Все частицы с одинаковым химическим составом, структурой и агрегатным состоянием несмотря на то, что они рассеяны по объему материала, объединяют понятием «фаза».
Фаза — это однородная по химическому составу и атомной структуре часть системы, граничащая с другими фазами по физическим поверхностям раздела. Совокупность фаз в физической химии называют системой. Гетерогенные материалы характеризуются фазовым составом (в случае горных пород — это минералогический состав). Фазами являются химические элементы, химические соединения и растворы (твердые, жидкие и газообразные). Газы при смешивании всегда образуют растворы в любых сочетаниях и пропорциях. Для того чтобы получить твердый раствор, компоненты должны быть растворимы в жидком (расплавленном) состоянии.
В зависимости от природы компонентов при отвердевании состояние раствора сохраняется или расплав распадается на механическую смесь кристаллов двух (или более) фаз. В твердом растворе атомы одного вещества либо занимают промежутки между атомами другого вещества (твердый раствор внедрения), либо вытесняют атомы другого вещества и занимают их место (твердый раствор замещения).
Многофазная система всегда представляет собой механическую смесь частиц той или иной степени дисперсности.
Дисперсность — эго раздробленность вещества, характеризуемая средним размером частиц dcp; дисперсностью D = I /Др; удель
ной поверхностью Л’у;| = S/m, где S — общая площадь поверхности всех частиц; т — масса всех частиц.
Удельная поверхность портландцемента составляет 0,25… 0,35 м2Д, бентонитовой глины — около 200 м2/г.
Принято подразделять частицы на коллоидные (dcp — 10“9… 10“6 м), способные участвовать в броуновском движении; тонкодисперсные (dcр = 10~6… 10 4 м), для которых сила тяжести не позволяет им участвовать в тепловом движении, но еще не превышает силы молекулярного притяжения частиц; грубодисперсные (dcp> 10-4 м), контакты между которыми разрываются под действием силы тяжести.
Дисперсность является следствием многофазности. Однофазная система не может быть дисперсной. С уменьшением среднего размера частиц dcp (увеличением дисперсности фаз) увеличивается площадь межфазной поверхности и возрастает однородность системы с точки зрения ее физико-механических свойств. Когда dcp = 0 или D = °°, межфазная поверхность исчезает и система становится однофазной (гомогенной).
Поверхностное натяжение. Поверхностное натяжение является мерой химической неоднородности фаз. Рассмотрим происхождение поверхностного натяжения на примере поверхности вода — воздух (рис. 1.1). Молекула воды А внутри объема жидкости испытывает притяжение со стороны окружающих ее молекул, одинаковое во всех направлениях. Равнодействующая этих сил равна нулю, и молекула движется беспорядочно, не имея преобладающего направления. Молекула В, находящаяся на поверхности, со стороны воды притягивается такими же силами, как и молекула в объеме, а со стороны воздуха силы притяжения значительно меньше. Равнодействующая сил R в этом случае не равна нулю и направлена вертикально вниз. Под действием силы R молекула стремится переместиться внутрь жидкости.
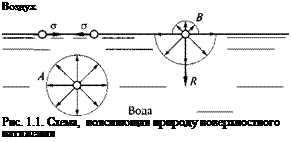 |
В результате в поверхностном слое возникает некоторое разряжение молекул, так что расстояния между ними увеличиваются, а силы взаимного притяжения возрастают на величину о, называемую поверхностным натяжением. Поверхностное натяжение ха-
рактеризуют силой (в ньютонах), которую нужно приложить, чтобы разорвать полосу поверхности шириной 1 м. Единица измерения о — Н/м.
Наличие нескомпенсированных сил, действующих на молекулы в поверхностном слое, придает поверхности (жидкой или твердой) способность притягивать молекулы других фаз. Если притягиваются и накапливаются на поверхности определенные атомы или молекулы из соседней газовой фазы или жидкого раствора, то такое явление называется адсорбцией. Взаимное притяжение (сцепление) молекул двух фаз на границе их раздела называется адгезией, а притяжение молекул внутри одной фазы — когезией (см. подразд. 1.3).
Способность поверхности тела совершать работу означает, что она обладает определенной энергией G, которую называют свободной поверхностной энергией. В отличие от свободной связанную энергию можно передать только в форме теплоты, а согласно второму началу термодинамики теплоту нельзя превратить в работу непосредственно. Поверхность не обладает связанной энергией (это свойство объема), поэтому, говоря о поверхностной энергии, слово «свободная» можно опустить. Численно удельная (на 1 м2 площади) поверхностная энергия равна поверхностному натяжению а, но измеряется в Дж/м2. Такие единицы получаются из единиц измерения а путем умножения числителя и знаменателя на одну и ту же величину — 1 м, что не изменяет числового значения: 1 Н/м = 1 Нм/(мм) = 1 Дж/м2.
Значит, поверхностное натяжение о можно одновременно трактовать и как удельную поверхностную энергию. Эта величина определяет различие между соприкасающимися фазами. Чем резче различаются фазы, тем больше о. Если различия отсутствуют, то о = 0, т. е. нет межфазной поверхности. Поверхностная энергия системы, равная G = oS^m, определяется качеством поверхности о и ее количеством — площадью S= 3’уд/и. Таким образом, материалы, являясь гетерогенными системами, обладают поверхностной энергией, играющей значительную роль в формировании свойств материалов и обусловливающей поверхностные процессы и явления, которые будут описаны далее.
Классификация материалов как композиционных систем. Выделим в структуре материала две части. Одна из них, являющаяся непрерывной дисперсионной средой (матрицей), вмещает в себя другую — раздробленную, состоящую из разобщенных частиц и называемую условно дискретной фазой, хотя фазой, как таковой, она может и не являться, а быть многофазной. В зависимости от агрегатного состояния этих двух структурных составляющих можно выделить девять типов материалов как многофазных систем (табл. 1.1).
В зависимости от агрегатного состояния дисперсионной среды мы имеем материалы, представленные на одной из трех стадий
|
Дисперсная система |
Примеры материалов |
Характерные свойства материалов |
|
|
Диспер сионная среда |
Дискретная фаза |
||
|
Твердая |
Твердая |
Горные породы, бетон, керамические материалы, наполненные пластмассы |
Прочность, твердость, упругость |
|
Жидкая |
Влажные или водонасыщенные пористые материалы (легкие бетоны, пенопласты, древесина и др.) |
Влажность, водо — поглощение |
|
|
Газооб разная |
Пористые материалы (легкие бетоны, пенопласт, древесина) в сухом состоянии |
Пористость |
|
|
Жидкая |
Твердая |
Бетонная смесь, керамическая масса, формовочные полимерные массы, мастики, малярные суспензии (краски и эмали) |
Пластичность, вязкость, формує мость |
|
Жидкая |
Битумные, полимерные и другие эмульсии (основа мастик, клеев, красок, технологических жидкостей) |
Диспергируе — мость, устойчивость к расслоению |
|
|
Г азообразная |
Вспененные формовочные массы (для получения пенопластов, газобетона и др.) |
Кратность вспенивания, устойчивость пены, пористость |
|
|
Газооб разная |
Т вердая |
Цементы и другие вяжущие вещества, глина, песок, щебень, стекловата, порошкообразные наполнители |
Дисперсность, зерновой состав, пустотность |
|
Жидкая |
Распыляемые жидкости (лаки, краски, мастики, глазури, гидрофобизаторы) |
Качество распыления |
|
|
Г азообразная |
Дисперсные системы отсутствуют |
— |
технологического процесса. На стадии подготовки компоненты сырьевой смеси представляют собой раздробленную массу с воздушной дисперсионной средой (цемент, песок, глина, щебень и т. д.). На стадии формования материалы имеют жидкую дисперсионную среду и представляют собой пластичные смеси (бетонная
смесь, керамическая масса), которым придают форму будущих изделий и которые характеризуются пределом текучести, вязкостью, формуемостью (технологическими свойствами). Стадию готового продукта представляют материалы (бетон, кирпич), характеризуемые прочностью, твердостью, долговечностью (техническими свойствами), придаваемыми твердой дисперсионной средой.
Для перехода от стадии формования к готовому продукту дисперсионная среда должна быть представлена связующим, способным переходить из жидкого состояния в твердое. Отвердевание происходит в результате либо физико-химических процессов, при которых изменяется химический состав продуктов (гидратация вяжущих, реакции получения полимеров), либо физических процессов (застывания расплава металлов, стекломассы, полимеров, битумов, выделения из пересыщенных растворов при испарении растворителя пленкообразующих веществ).
Строительные материалы и изделия
Строительные материалы — основа строительства. Знание их особенностей и правильное применение являются залогом надежности и экономичности зданий и сооружений. Иногда строители сами изготавливают строительный раствор или бетон, и знание закономерностей формирования структуры и свойств материалов в зависимости от их состава и технологических факторов поможет избежать серьезных ошибок.
Строительные материалы классифицируются по различным признакам.
По назначению строительные материалы подразделяются на конструкционные (выполняющие несущую функцию), стеновые (выполняющие одновременно несущую и теплоизолирующую функции), теплоизоляционные, акустические, кровельные, паро — и гидроизоляционные, облицовочные, антикоррозионные, антисептические, огнезащитные и др.
По происхождению строительные материалы подразделяются на природные и искусственные. Природные материалы (древесина и каменные породы) в своем естественном состоянии обладают необходимыми для строительства свойствами и требуют только механической обработки. Искусственные материалы получают из природного и техногенного сырья в результате термических, физико-химических и механических процессов, составляющих технологию получения этих материалов.
Искусственные материалы, в свою очередь, подразделяются по способу получения на следующие группы.
I. Материалы, получаемые высокотемпературной обработкой минерального сырья:
• материалы, получаемые из минеральных расплавов (металлы и металлические сплавы, стекло, ситаллы, каменное и шлаковое литье);
• материалы, получаемые спеканием (частичным расплавлением) сырьевых смесей (керамические материалы, цементный клинкер);
• материалы, получаемые в результате термического разложения и твердофазовых реакций (вяжущие вещества).
II. Материалы и изделия на основе неорганических вяжущих веществ: строительные растворы, тяжелые, легкие и специаль-
ные бетоны, сборные железобетонные изделия, силикатные, асбестоцементные и другие изделия. Основой получения этих материалов являются химические реакции взаимодействия вяжущих веществ с водой при нормальных или повышенных температурах.
III. Материалы и изделия на основе органических связующих веществ (битумов и полимеров): пластмассы, мастики и герметики, рулонные кровельные и гидроизоляционные материалы, асфальтовые растворы и бетоны, полимербетоны, лакокрасочные, геосинтетические и другие материалы.
В материалах II и III групп можно выделить функционально различные составные части, поэтому их называют композиционными.
Первым (главным) компонентом композиционных материалов является связующее — вещество, способное переходить из жидкообразного состояния в твердое. Основой связующего являются вяжущие вещества, битумы и полимеры.
Вторым компонентом в композитах являются инертные рыхлые материалы — заполнители (песок, гравий, щебень и др.) и наполнители (тонкие минеральные порошки, волокна различного происхождения, технические ткани). Назначение заполнителей и наполнителей, с одной стороны — снизить стоимость материала, так как связующее является более дорогим компонентом, а с другой стороны — сообщить материалу те или иные полезные свойства, например повысить прочность, твердость, теплостойкость, снизить усадку и т. д.
Третьим компонентом являются различные добавки, применяемые в малых дозах, но позволяющие существенно скорректировать свойства композиции.
Связующее вещество в композиционных материалах образует матрицу — непрерывную среду, включающую в себя частицы или волокна наполнителя (заполнителя).
В курсе строительных материалов рассматриваются закономерности процессов и явлений, лежащих в основе получения материалов с заданными свойствами, а также происходящих при эксплуатации материалов в конструкциях и определяющих их долговечность.
Изучение данного курса позволит сформировать знания основ строительного материаловедения, общих законов структурообра — зования искусственные строительных конгломератов, связи строительно-технических свойств материалов с их составом и строением; приобрести навыки по испытанию строительных материалов, оценке их физико-технических свойств, стойкости и надежности, правильному выбору материалов, их оптимальных сочетаний в конкретных условиях строительства.