Поверхностные явления и формирование свойств материалов
Явления смачивания. Если молекулы жидкости взаимодействуют с молекулами твердого тела сильнее, чем между собой, то капля жидкости растекается по поверхности — смачивает ее. При этом краевой угол смачивания 0 < 90°, a cos 0 > 0 (рис. 1.2, а).
Если между собой молекулы жидкости взаимодействуют сильнее, чем с молекулами твердого тела, то капля жидкости не растекается: 0 > 90°, cos 0 < 0. Крайними случаями этого процесса являются полное смачивание, когда 0 = 0, cos 0 = 1 (жидкость растекается до образования мономолекулярного слоя) и полное несмачивание, когда 0 = 180°, cos 0 =-1 (капля стремится сохранить сферическую форму).
Способность поверхностей тел смачиваться водой является результатом действия трех сил поверхностного натяжения о на границах твердое тело —газ (т — г); твердое тело—жидкость (т—ж);
а
жидкость —газ (ж—г) (рис. 1.2, б). Растекание капли прекратится, когда наступит равновесие этих сил, действующих на каждой единице длины периметра смачивания. Условие равновесия выражается уравнением Юнга:
ат_г = ат_ж + ox_rcos 0 или cos 0 = (ат_г-ах_ж)/стж_г. (1.1)
По способности смачиваться водой поверхности тел подразделяются на гидрофильные (смачиваемые) с cos 0 > 0 и гидрофобные (несмачиваемые) с cos 0 < 0.
Краевой угол смачивания составляет: для кварца — 0°, малахита — 17°, графита — 55°, талька — 69°, парафина — 106°, тефлона —
 |
Реальная поверхность никогда не бывает совершенно чистой. Присутствие на поверхности загрязняющих веществ, оксидных пленок, адсорбированного воздуха оказывает сильное влияние на смачиваемость. Гидрофильная поверхность кварца, покрытая тонкой пленкой масла или жира, становится гидрофобной.
Адгезия и когезия. В гетерогенных системах различают межмолекулярные взаимодействия (притяжение молекул) между разными фазами (адгезия) и внутри одной фазы {когезия).
Силы адгезии действуют на очень малых расстояниях. Для их возникновения необходим контакт фаз. В случае твердых тел обеспечить значительную площадь контакта чрезвычайно трудно даже при высоком давлении. Если сложить пластины с плоскими шлифованными поверхностями, то можно почувствовать их слипание. Значительные силы адгезии возникают, если смочить поверхности пластин водой или другой жидкостью, так как жидкость вступает в контакт с твердым телом по всей площади смоченной поверхности. Таким образом, чтобы обеспечить хорошее прилипание, необходимо одну из фаз перевести в жидкое или вязкопластичное состояние. Этот принцип используется при склеивании, пайке, сварке материалов, нанесении на поверхность лакокрасочных, гидроизоляционных покрытий, штукатурных растворов, получении композиционных материалов (пластмасс, бетона, керамических изделий), когда наполнители или заполнители сме
шивают с жидким связующим, которое впоследствии переводят в твердое состояние.
Когезионное взаимодействие характеризуют работой когезии 1VK, Дж/м2, необходимой для разрыва фазы, по сечению единичной площади. При разрыве фазы образуются две поверхности (площадь каждой равна единице) с поверхностным натяжением в случае жидкости <тж_г, а в случае твердого тела ох__г (рис. 1.3, а). Следовательно, работа когезии жидкости равна WK = 2ож_г, а твердого тела — = 2от_г.
Работа адгезии определяется энергией, затраченной на разрыв связи по контакту между фазами, отнесенной к единице площади. Определим работу адгезии Wa, Дж/м2, между жидкостью и твердым телом в газообразной среде. До разрыва поверхностная энергия единицы площади контакта равна от_ж. После разрыва образуются две поверхности с поверхностным натяжением, равным на одной из них аж_г, на другой — от_, (рис. 1.3, б). В этом случае работа адгезии определяется по уравнению Дюпре:
В/, — ож_г + от_г— от_ж. (1.2)
Выразим от_г из уравнения (1.1) и подставим в уравнение (1.2). Получим: fVa = стж_г(1 + cos0). Величины аж_г и cos в определяются экспериментально.
Отношение работ адгезии и когезии для случая твердое тело — жидкость зависит только от краевого угла смачивания:
К/ И4 = стж-і( 1 + СО50)/2ОЖ„Г = (1 + cos0)/2.
При cos0 = 1 (полное смачивание) Wa = WK, т. е. разрыв при растяжении равновероятен как по контакту, так и по жидкости. При cos0 =-1 (полное несмачивание) Wa = 0, следовательно, нет адгезии. В промежуточном случае, при cos0 = 0, Wa = 0,5 WK.
|
Жидкость |
Жидкость |
|||||
|
Жидкость |
/ |
Жидкость |
/ |
|||
|
а = 0 |
сг Газ -Г |
ж — Г |
<*т-ж |
ч стж Газ -г |
||
|
£=1 |
5=1 |
G’p |
||||
|
—— |
Жидкость |
Твердое тело |
Твердое тело |
|
а |
|
б |
|
Рис. 1.3. Иллюстрация к выводу уравнения Дюпре: а — когезия; б — адгезия; S — площадь столбика |
|
о л -s;
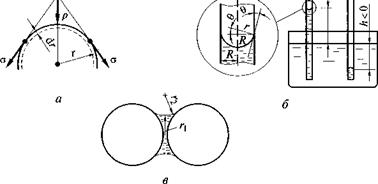
Рис. 1.4. Происхождение внутреннего давления в жидкости (а), поднятие (опускание) жидкости в капилляре (б) и удержание твердых частиц водной манжетой (в) |
Работу адгезии между твердыми фазами определить невозможно, так как обычно неизвестно поверхностное натяжение на границе твердое тело — воздух. В этом случае адгезию характеризуют силой, необходимой для разрыва адгезионного соединения по единице площади.
Капиллярные явления. Благодаря поверхностному натяжению жидкости стремятся принять сферическую форму. Этому препятствует сила тяжести, которая при большом объеме жидкости делает поверхность плоской. С уменьшением объема жидкости Ксила тяжести снижается пропорционально кубу радиуса капли, в то время как поверхность капли уменьшается пропорционально квадрату радиуса.
При малых размерах частиц силы поверхностного натяжения начинают преобладать над силами тяжести и поверхность приобретает кривизну, благодаря которой капля оказывается сжатой внутренним давлением р, обусловленным силами поверхностного натяжения о и направленным к центру кривизны (рис. 1.4, а). Под действием этого давления объем капли уменьшается на 8Ки совершается работа рЪ V В то же время сокращается площадь поверхности капли на 5.S’ и уменьшается ее поверхностная энергия на o8S.
При равновесии, если считать температуру тела неизменной, согласно закону сохранения энергии можно записать (уравнение Лапласа):
рЪУ — a&S, или р = об^/бК. (1.3)
Для сферы
где г — радиус сферы.
Тогда р = 2а/г, где 1 /г — это дисперсность. Чем больше дисперсность, тем выше внутреннее давление в капле.
Искривление поверхности жидкости (образование мениска) имеет место в узких капиллярах. В зависимости от направления кривизны мениска (направления внутреннего давления р) происходит поднятие или опускание жидкости в капилляре (рис. 1.4, б). Это определяется смачиваемостью стенок капилляра. В гидрофильном капилляре (0 < 90°) мениск вогнутый, происходит поднятие жидкости; в гидрофобном капилляре (0 > 90°) мениск выпуклый, жидкость выталкивается из капилляра.
Рассчитаем высоту h поднятия жидкости в гидрофильном капилляре радиусом R. В состоянии равновесия капиллярное давление р, определяемое по формуле (1.3), уравновешено весом столбика жидкости, равным рgh, т. е. рgh = 055/8К Полагая, что мениск имеет сферическую форму (65/5V = 2/г), и учитывая соотношение между радиусом мениска г и радиусом капилляра R (г = R/cos0), получаем
где о — поверхностное натяжение воды; 0 — краевой угол смачивания; р — плотность воды; g — ускорение свободного падения.
Из формулы (1.4) следует, что для одной и той же жидкости (о = const, р = const) высота капиллярного поднятия тем больше, чем меньше радиус капилляра и выше его гидрофильность (cos0). При cos 0 < 0 (гидрофобный капилляр), h < 0 жидкость не втягивается в капилляр. Для того чтобы вдавить жидкость в гидрофобный капилляр до уровня h = 0, нужно приложить давление р =-2ocos0/7?. На этом принципе основан способ гидроизоляционной защиты конструкций. Материалы обрабатывают специальными проникающими составами, которые покрывают стенки капилляров тончайшей гидрофобной пленкой (см. подразд. 14.12). При этом жидкая влага не может проникнуть в поры материала, а пары воды могут свободно выходить из пор.
Бетонная смесь и керамическая масса обладают связностью в основном за счет сил поверхностного натяжения воды, действующих в водных манжетах, имеющих два радиуса кривизны (рис. 1.4, в). Радиус ги лежащий в плоскости, перпендикулярной рисунку, всегда больше радиуса г2, лежащего в плоскости рисунка, поэтому давление в водной манжете ниже внешнего, что и способствует удержанию частиц вместе.
Адсорбция. Поверхность раздела фаз, обладая свободной энергией, притягивает к себе атомы (ионы) или молекулы веществ,
находящихся в газовой фазе или жидком растворе, что ведет к понижению поверхностной энергии. Это явление называется адсорбцией, а обратный процесс называется десорбцией. В результате адсорбции концентрация вещества в объеме раствора снижается, а в поверхностном слое возрастает до тех пор, пока не установится равновесие. Если в растворе находится несколько веществ, то предпочтительнее адсорбируется то, которое сильнее уменьшает поверхностное натяжение. Твердая фаза является адсорбентом (веществом, на поверхности которого происходит адсорбция) по отношению к жидкости или газу. На поверхности раздела жидкость-жидкость или жидкость —газ могут адсорбироваться молекулы как из одной, так и из другой фазы. В этом случае адсорбат (адсорбированное вещество) представляет собой разделительный слой между ними.
Адсорбция бывает физической — обратимой и химической (или хемосорбцией) — необратимой. При физической адсорбции между адсорбентом и адсорбатом действуют силы межмолекулярного притяжения, а при химической адсорбции — силы химической связи (силы, которые действуют между атомами в молекулах). При хемосорбции происходит химическая реакция между адсорбентом и адсорбатом с образованием поверхностной молекулы, одна часть которой принадлежит адсорбенту, а другая — адсорбату.
Адсорбцию характеризуют величиной
А = Ms/S,
где Ms — масса адсорбата в поверхностном слое; S — площадь межфазной поверхности.
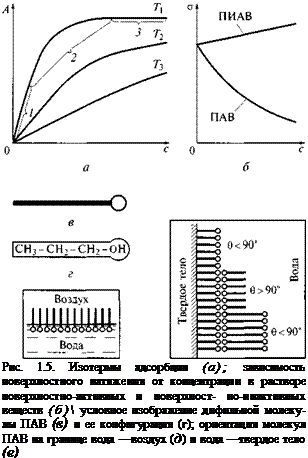
Изотермы адсорбции из раствора (графики зависимости адсорбции А от концентрации растворенного вещества с при постоянной температуре Т) приведены нарис. 1.5, а(Т3> Т2> Г,). Крутой подъем изотермы (участок 1) характерен для относительно свободной поверхности адсорбента. Полному насыщению поверхности адсорбатом соответствует участок 3. Участок 2 является промежуточным. С повышением температуры усиливается тепловое движение молекул и адсорбция уменьшается, однако предел, к которому она стремится, остается тем же, только для его достижения требуется высокая концентрация, часто нереализуемая.
При адсорбции выделяется теплота, так как снижается поверхностная энергия адсорбента.
Если с увеличением концентрации вещества поверхностное натяжение на границе раздела фаз понижается, то такое вещество называется поверхностно-активным (ПАВ). Вещества, повышающие поверхностное натяжение раствора с увеличением концентрации, называются поверхностно-инактивными (ПИАВ) (рис. 1.5, б). Такими веществами по отношению к воде являются неоргани-
д е
ческие соли, которые взаимодействуют с водой сильнее, чем молекулы воды между собой.
Молекулы ПАВ дифильны, т. е. имеют гидрофобную (выталкиваемую из воды) углеводородную часть (цепочку из групп СН2) и гидрофильную (втягиваемую в воду) функциональную группу: —СООН, —NH2, —ОН, —О — , —S020H и др. В условном изображении дифильной молекулы функциональную группу обозначают кружочком, а гидрофобный углеводородный радикал — чертой (рис. 1.5, в, г). В адсорбционном слое дифильные молекулы обращены полярной группой к полярной фазе (например, к воде), а неполярным углеводородным радикалом — к неполярной фазе (например, к воздуху) (рис. 1.5, д). На твердой поверхности ПАВ способны образовывать полимолекулярные слои (рис. 1.5, ё), при
чем от числа мономолекулярних слоев зависит, будет ли поверхность гидрофильной (0 < 90°) или гидрофобной (0 > 90°).
Широко применяются ПАВ в технологии строительных материалов в качестве добавок пластификаторов бетонной смеси, полимерных композиций, керамической массы; эмульгаторов и стабилизаторов в лакокрасочных материалах; пенообразователей при получении пенобетона и пеносиликата и др.